졸레드론산 주사, 치주파괴 부작용 발현
고칼슘혈증 치료제 '졸레드론산 주사액'에서 치주파괴, 잇몸염 등의 부작용이 추가 확인됐다.
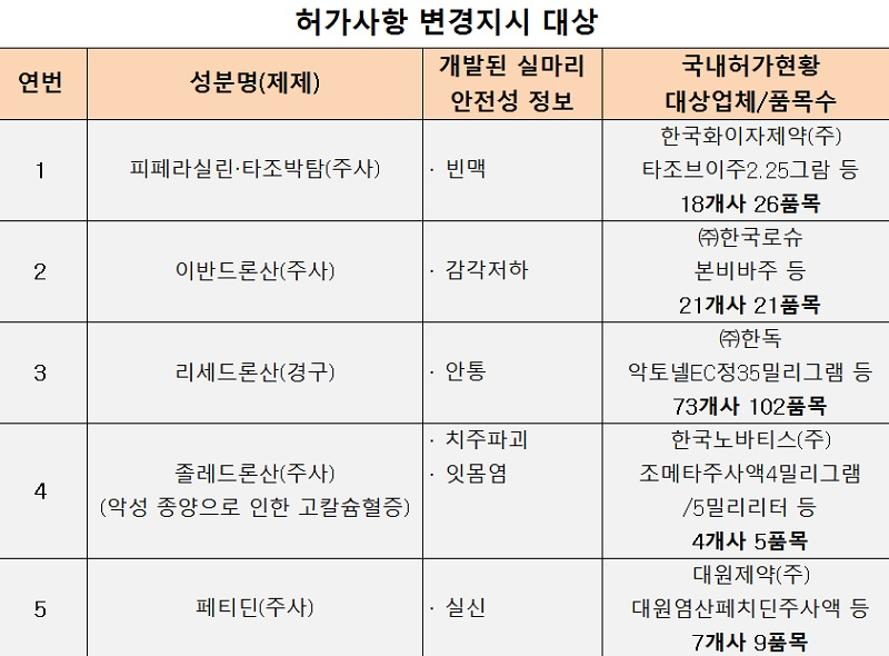
식품의약품안전처는 그간 국내에서 수집된 의약품 부작용 정보를 분석·평가, 5개 성분 163개 품목의 허가사항에 일부 이상반응을 추가한다고 29일 밝혔다.
식약처 조사 결과, 약성종양으로 인한 고칼슘혈증 치료에 쓰는 졸레드론산 주사제는 치주파괴, 잇몸염 등의 이상반응이 추가 관찰돼 허가사항에 반영했다.
골다공증 치료 목적으로 쓰이는 졸레드론산 약제는 이번 이상반응 추가 대상이 아니며, 고칼슘혈증 치료제만 대상이다.
졸레드론산의 대표 품목은 한국노바티스의 '조메타주사액4mg/5ml'로 이 품목은 신제품(조메타레디주사액4mg/100ml) 출시에 따라 회사측이 공급을 중단한 상태다.
이 밖에 한국노바티스의 '조메타레디', 삼양바이오팜의 '졸레닉주사', 지-리페의 '조본주사액', 동국제약의 '조메본프리필드' 등 4개사의 5개 품목이 해당된다.
항생제 '피페라실린·타조박탐(주사제)'에는 빈맥의 이상반응을 추가한다. 해당 품목은 한국화이자제약의 '타조브이주2.25g' 등 18개사 26개 품목이다.
골다공증 치료제 '이반드론산(주사제)'는 신경감각 저하의 이상반응이 추가 관찰돼 한국로슈 '본비바주' 등 21개사 21개 품목에 해당 내용을 추가한다.
골다공증 치료제 '리세드론산(경구제)' 역시 안통(눈의 통증)의 이상반응을 추가한다. 한독의 '악토넬EC정35밀리그램' 등 73개사 102개 품목이 해당된다.
식약처는 1989년부터 2014년 상반기까지 국내에서 보고된 의약품 부작용 정보에 대해 한국의약품안전관리원이 분석한 실마리 정보를 바탕으로 중앙약사심의워원회의 자문을 거쳐 이번 조치를 취했다.
식약처는 "이번 허가사항 변경이 국민들의 안전한 의약품 사용에 도움이 될 것이며, 앞으로도 부작용 사례에 대한 지속적으로 점검해 필요한 안전조치를 실시하겠다"고 말했다.
식품의약품안전처는 그간 국내에서 수집된 의약품 부작용 정보를 분석·평가, 5개 성분 163개 품목의 허가사항에 일부 이상반응을 추가한다고 29일 밝혔다.
식약처 조사 결과, 약성종양으로 인한 고칼슘혈증 치료에 쓰는 졸레드론산 주사제는 치주파괴, 잇몸염 등의 이상반응이 추가 관찰돼 허가사항에 반영했다.
골다공증 치료 목적으로 쓰이는 졸레드론산 약제는 이번 이상반응 추가 대상이 아니며, 고칼슘혈증 치료제만 대상이다.
졸레드론산의 대표 품목은 한국노바티스의 '조메타주사액4mg/5ml'로 이 품목은 신제품(조메타레디주사액4mg/100ml) 출시에 따라 회사측이 공급을 중단한 상태다.
이 밖에 한국노바티스의 '조메타레디', 삼양바이오팜의 '졸레닉주사', 지-리페의 '조본주사액', 동국제약의 '조메본프리필드' 등 4개사의 5개 품목이 해당된다.
항생제 '피페라실린·타조박탐(주사제)'에는 빈맥의 이상반응을 추가한다. 해당 품목은 한국화이자제약의 '타조브이주2.25g' 등 18개사 26개 품목이다.
골다공증 치료제 '이반드론산(주사제)'는 신경감각 저하의 이상반응이 추가 관찰돼 한국로슈 '본비바주' 등 21개사 21개 품목에 해당 내용을 추가한다.
골다공증 치료제 '리세드론산(경구제)' 역시 안통(눈의 통증)의 이상반응을 추가한다. 한독의 '악토넬EC정35밀리그램' 등 73개사 102개 품목이 해당된다.
식약처는 1989년부터 2014년 상반기까지 국내에서 보고된 의약품 부작용 정보에 대해 한국의약품안전관리원이 분석한 실마리 정보를 바탕으로 중앙약사심의워원회의 자문을 거쳐 이번 조치를 취했다.
식약처는 "이번 허가사항 변경이 국민들의 안전한 의약품 사용에 도움이 될 것이며, 앞으로도 부작용 사례에 대한 지속적으로 점검해 필요한 안전조치를 실시하겠다"고 말했다.
저작권자© 메디게이트뉴스, 무단 전재 및 재배포 금지
송연주 기자 (yjsong@medigatenews.com)열심히 하겠습니다.
전체 뉴스 순위
칼럼/MG툰
English News
- LOTTE BIOLOGICS Hosts Technology Development Forum to Foster Future Innovation
- Hanmi Highlights Next-Generation Obesity Pipelines at ObesityWeek 2025
- SK bioscience Earns 'A' Rating in KCGS ESG Assessment for Fourth Consecutive Year
- Huons N to Acquire Health Functional Food Manufacturer 'Biorosette'
- European Commission Grants Approval of Remsima IV Liquid Formulation, World's First Liquid Formulation of IV Infliximab
유튜브
사람들