삼성 첫 바이오시밀러 허가 획득
'엔브렐' 시밀러 … MSD가 국내 판매
바이오 의약품 개발에 가세한 삼성이 첫 바이오시밀러를 내놨다.
삼성바이오에피스는 삼성의 첫 번째 바이오시밀러인 '브렌시스'가 식품의약품안전처로부터 품목 허가를 받았다고 7일 밝혔다.
바이오시밀러(동등생물의약품)는 이미 품목허가를 받은 생물의약품과 품질, 비임상, 임상 시험에서 동등성을 입증한 의약품을 말한다.
브렌시스의 오리지널 제품은 화이자의 엔브렐로, 엔브렐이 가진 △류마티스 관절염 △건선성 관절염 △축성 척추관절염(강직성 척추염, 방사선상으로 확인되지 않는 축성 척추관절염) △건선 등의 적응증을 획득했다.
보건복지부 약가고시 등 관련 절차를 거치면 올해 말 또는 내년 초 출시될 전망이다.
국내 판매는 한국MSD가 맡는다. 지난 2013년 삼성과 미국 MSD본사의 마케팅 계약 체결에 따른 협력이다.
삼성바이오에피스는 브렌시스가 오리지널 제품과 동등한 약동학(PK), 효능 및 안전성을 가지고 있는지 확인하기 위해 여러 국가에서 1상과 3상 임상을 진행했다.
3상은 10개 국가, 73개의 병원에서 596명의 중등도에서 중증의 류마티스 관절염 환자를 대상으로 24주간 진행했으며, 1상은 독일에서 건강한 성인 남성 138명을 대상으로 진행했다.
임상 1상과 3상 결과는 올해 6월, 2015 유럽 류마티스 학회(EULAR: European League Against Rheumatism)에서 발표된 바 있으며, EULAR의 공식학회지인 ARD(Annals of the Rheumatic Diseases)에 임상 3상(24주) 결과가 등재됐다.
삼성바이오에피스 고한승 대표는 "삼성바이오에피스가 설립된지 만 3년 반만에 첫 제품의 품목 허가를 받았다"면서 "오리지널 제품과 동등한 효과와 안전성을 갖고 있으면서 경제성까지 갖춘 바이오시밀러가 출시되면, 환자와 정부에 모두 도움이 될 것"이라고 기대했다.
한편, 바이오시밀러는 국내 제약산업이 선도적으로 개발하는 분야로 현재까지 4개 제품이 허가 됐다.
2012년 세계 최초 항체 바이오시밀러인 '램시마주100mg(셀트리온)' 허가를 시작으로 2014년 '허쥬마주1500mg, 440mg(셀트리온)', '다빅트렐주사25mg(한화케미칼)'가 허가되었으며, 2015년 9월에는 '브랜시스50mg 프리필드시린지'(삼성바이오에피스)가 추가되어 4개 제품으로 늘어났다.
이뿐 아니라 22개 품목이 개발 중이다.
22개 품목 중 16개 품목은 항체의약품이며, 이 중 약 63%인 10개는 국내 개발의약품이다. 나머지 6개는 인슐린 및 에리스로포이에틴(적혈구생성인자) 개발을 위한 임상시험 3건이 각각 진행 중이다.
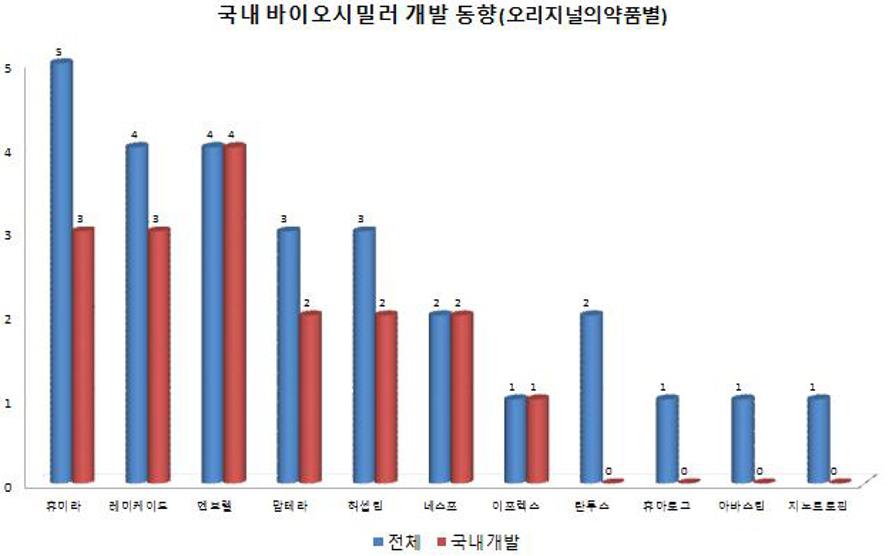
가장 많이 개발되는 것은 '휴미라'의 시밀러로 5개 품목이 개발 중이다. 이어 '레미케이드'(임상 3개 품목, 허가 1개 품목), '엔브렐'(임상 2개 품목, 허가 2개 품목), '맙테라'(임상 3개 품목), '허셉틴'(임상 2개 품목, 허가 1개 품목)의 순이다.
삼성바이오에피스는 삼성의 첫 번째 바이오시밀러인 '브렌시스'가 식품의약품안전처로부터 품목 허가를 받았다고 7일 밝혔다.
바이오시밀러(동등생물의약품)는 이미 품목허가를 받은 생물의약품과 품질, 비임상, 임상 시험에서 동등성을 입증한 의약품을 말한다.
브렌시스의 오리지널 제품은 화이자의 엔브렐로, 엔브렐이 가진 △류마티스 관절염 △건선성 관절염 △축성 척추관절염(강직성 척추염, 방사선상으로 확인되지 않는 축성 척추관절염) △건선 등의 적응증을 획득했다.
보건복지부 약가고시 등 관련 절차를 거치면 올해 말 또는 내년 초 출시될 전망이다.
국내 판매는 한국MSD가 맡는다. 지난 2013년 삼성과 미국 MSD본사의 마케팅 계약 체결에 따른 협력이다.
삼성바이오에피스는 브렌시스가 오리지널 제품과 동등한 약동학(PK), 효능 및 안전성을 가지고 있는지 확인하기 위해 여러 국가에서 1상과 3상 임상을 진행했다.
3상은 10개 국가, 73개의 병원에서 596명의 중등도에서 중증의 류마티스 관절염 환자를 대상으로 24주간 진행했으며, 1상은 독일에서 건강한 성인 남성 138명을 대상으로 진행했다.
임상 1상과 3상 결과는 올해 6월, 2015 유럽 류마티스 학회(EULAR: European League Against Rheumatism)에서 발표된 바 있으며, EULAR의 공식학회지인 ARD(Annals of the Rheumatic Diseases)에 임상 3상(24주) 결과가 등재됐다.
삼성바이오에피스 고한승 대표는 "삼성바이오에피스가 설립된지 만 3년 반만에 첫 제품의 품목 허가를 받았다"면서 "오리지널 제품과 동등한 효과와 안전성을 갖고 있으면서 경제성까지 갖춘 바이오시밀러가 출시되면, 환자와 정부에 모두 도움이 될 것"이라고 기대했다.
한편, 바이오시밀러는 국내 제약산업이 선도적으로 개발하는 분야로 현재까지 4개 제품이 허가 됐다.
2012년 세계 최초 항체 바이오시밀러인 '램시마주100mg(셀트리온)' 허가를 시작으로 2014년 '허쥬마주1500mg, 440mg(셀트리온)', '다빅트렐주사25mg(한화케미칼)'가 허가되었으며, 2015년 9월에는 '브랜시스50mg 프리필드시린지'(삼성바이오에피스)가 추가되어 4개 제품으로 늘어났다.
이뿐 아니라 22개 품목이 개발 중이다.
22개 품목 중 16개 품목은 항체의약품이며, 이 중 약 63%인 10개는 국내 개발의약품이다. 나머지 6개는 인슐린 및 에리스로포이에틴(적혈구생성인자) 개발을 위한 임상시험 3건이 각각 진행 중이다.
가장 많이 개발되는 것은 '휴미라'의 시밀러로 5개 품목이 개발 중이다. 이어 '레미케이드'(임상 3개 품목, 허가 1개 품목), '엔브렐'(임상 2개 품목, 허가 2개 품목), '맙테라'(임상 3개 품목), '허셉틴'(임상 2개 품목, 허가 1개 품목)의 순이다.
저작권자© 메디게이트뉴스, 무단 전재 및 재배포 금지
송연주 기자 (yjsong@medigatenews.com)열심히 하겠습니다.
전체 뉴스 순위
칼럼/MG툰
English News
- Hanmi’s Next-Generation EZH1/2 Dual Inhibitor Demonstrates Potential to Overcome Resistance Mechanisms
- Celltrion announces U.S. FDA approval of additional presentation of STEQEYMA
- Daewoong Pharmaceutical and Salipro Biotech, Collaboration Agreement to Advance Development of Novel Therapeutics
- “Uncertain international circumstances and enlightened self-interest help prevent greater losses.”
- Lunit Study in Radiology Highlights Trust Gap Between Radiologists and AI in Breast Cancer Screening
유튜브
사람들
댓글보기(0)