식약처 "셀트리온 코로나19 치료제 40일 내 허가심사 완료하겠다"
"비임상자료부터 제조·위해성 관리까지...안전성·효과성 철저히 검증 예정"
식품의약품안전처는 29일 셀트리온의 코로나19 치료제 렉키로나주960mg(레그단비맙·코드명 CT-P59)에 대한 품목허가 신청이 접수됐다고 밝혔다.
이번에 허가 신청한 렉키로나주는 셀트리온에서 신약으로 개발 중인 유전자재조합 중화항체치료제로, 주성분은 레그단비맙(Regdanvimab)이라는 국제일반명을 부여받은 코로나19 중화항체다. 코로나19중화항체는 코로나19 바이러스를 중화(무력화)할 수 있는 항체다.
이는 코로나19 완치자의 혈액에 존재하는 중화항체 유전자를 선별하고 선별·채취한 유전자를 대량 생산이 가능한 숙주 세포에 삽입(재조합)해 세포 배양 과정을 통해 생산 가능하다.
따라서 코로나19 완치자의 혈액에서 항체를 지속적으로 채취할 필요 없이 유전자 재조합된 세포를 이용해 중화항체를 대량 생산할 수 있다.
경증부터 중등증까지의 코로나19 환자 대상 임상 2상 완료
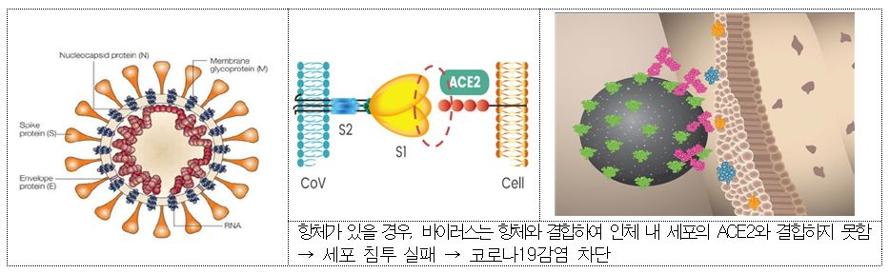
기존에 치료제로 허가된 베클루리주(렘데시비르)는 세포 내 감염된 코로나19 바이러스의 복제를 억제하는 반면, 렉키로나주(레그단비맙)는 코로나19 바이러스의 표면에 있는 인체 세포 결합 부위(Receptor Binding Domain)에 항체치료제가 대신 결합해 바이러스가 세포 내로 침투되는 것을 막게 된다.
식약처는 "렉키로나주의 예상 대상환자는 경증부터 중등증까지의 코로나19 환자다. 예상 용법과 제형은 90분간 정맥투여하는 주사제로, 예상 효능‧효과는 경증~중등증 코로나19 환자의 치료"라고 설명했다.
이어 "임상 2상이 10개월로 대폭 단축된 것은 식약처가 2월 개발 초기부터 허가신청까지 제조사와 밀접한 상담을 했기 때문"이라며 "탐색적 의미와 치료적 효과를 함께 확인할 수 있는 2상 임상시험이 설계될 수 있도록 대상 환자 확대 권고, 전문가 자문 등도 지원했다"고 밝혔다.
셀트리온은 식약처로부터 2상과 3상을 동시에 승인받은 다국가 임상시험 중 2상을 완료하고 허가를 신청하는 것으로, 3상은 이번 허가신청과는 관계없이 계획대로 진행될 예정이다.
2상은 경증~중등증의 코로나19 환자 327명을 대상으로 발열 등 7가지 코로나19 증상에 대한 회복 기간 단축과 바이러스 검사 시 양성에서 음성으로 전환하는 데 걸리는 기간 단축을 확인하는 것을 목표로 했다. 3상은 경증~중등증의 코로나19 환자 720명을 대상으로 산소 치료가 필요하거나 입원하는 등 증상이 악화되는 비율이 감소하는지 확인하는 것을 계획하고 있다.
식약처는 "앞으로 제출된 자료에 대해 첨단제품허가담당관이 예비심사한 후, 미리 구성된 코로나19 백신·치료제 허가전담심사팀의 분야별 전문가가 비임상, 임상, 품질 등 허가에 필요한 자료에 대해 심사하게 된다"면서 "이후 심사의견을 종합해 허가 타당성을 판단하고, 외부 전문가로 구성된 중앙약사심의위원회 자문 등을 거쳐 최종 허가할 예정"이라고 했다.
이어 "안전하고 효과 있는 코로나19 치료제가 국민에게 사용될 수 있도록 코로나19 백신·치료제 허가전담심사팀의 분야별 전문가와 외부 전문가 등을 활용해 안전성‧효과성을 철저히 검증하겠다"고 부연했다.
허가·심사 과정은? 비임상부터 제조, 위해성관리 등 전반 검토 시행
허가·심사 자료는 비임상시험, 임상시험, 품질, 위해성관리계획, 제조·품질관리 자료 등이다. 비임상시험 자료는 의약품을 사람에 투여하기 전에 동물실험을 통해 독성 및 효과를 검증한 자료이며, 임상시험 자료는 사람에게 투여했을 때 안전성과 효과성을 확인한 자료다.
품질자료는 해당 의약품의 제조공정관리, 품질관리를 위한 기준 및 시험방법 등에 관한 자료며, 위해성관리계획(RMP)은 환자용 사용설명서, 안전사용 보장조치 등 위해성 완화 조치방법을 포함하는 종합적인 안전관리 계획에 관한 자료다.
제조‧품질관리 기준(GMP) 실시상황평가 자료는 허가신청 품목과 관련된 시설·환경관리, 품질보증체계 등 10여종 자료다.
식약처는 "발열, 기침 등 환자의 증상 개선, 바이러스가 양성에서 음성으로 전환되는 기간 감소 등 치료효과를 확인하고, 안전성과 품질 확보 측면을 중점적으로 심사할 계획"이라며 "임상시험 대상자 안전과 시험결과의 신뢰성 등 임상시험 전반에 대한 규정 준수를 확인하고, 사전검토 결과를 포함해 제조소 실태조사를 실시할 계획"이라고 밝혔다.
이외에도 제출자료의 타당성과 임상현장에서의 수용성 등에 대해 독성전문가, 감염내과 등 전문의 등으로 구성된 코로나19 치료제 전문가협의체에 외부 자문 등을 의뢰하고, 최종적으로 중앙약사심의위원회의 자문을 받을 계획이다.
식약처는 신청 제품에 대한 허가심사 및 전문가 자문 결과 안전성‧효과성이 충분히 확인되는 경우, 현재 진행 중인 3상 임상시험 결과를 허가 후에 제출하는 것을 조건으로 허가한다는 방침이다. 특히 기존 처리 기간이 180일 이상인 것과 달리, 코로나19 백신·치료제인만큼 신속한 허가·심사를 위해 40일 이내에 처리할 예정이다.
한편 국내에서는 렉키로나주를 비롯해 코로나19 치료제로 개발 중인 항체치료제 등 총 15개 제품(13개 성분)에 대한 임상시험이 진행 중이다. 렉키로나주는 우리나라 외에도 미국, 유럽 등으로부터 임상 2/3상을 승인받아 진행 중이며, 내년부터 긴급사용승인(미국), 조건부 허가(유럽) 가능 여부 상담 등을 통해 해외 진출을 계획하고 있다.
국외의 경우 릴리社와 리제네론社의 항체치료제가 3상 임상시험을 진행하고 있으며, 미국에서 긴급사용승인을 받았다.
이번에 허가 신청한 렉키로나주는 셀트리온에서 신약으로 개발 중인 유전자재조합 중화항체치료제로, 주성분은 레그단비맙(Regdanvimab)이라는 국제일반명을 부여받은 코로나19 중화항체다. 코로나19중화항체는 코로나19 바이러스를 중화(무력화)할 수 있는 항체다.
이는 코로나19 완치자의 혈액에 존재하는 중화항체 유전자를 선별하고 선별·채취한 유전자를 대량 생산이 가능한 숙주 세포에 삽입(재조합)해 세포 배양 과정을 통해 생산 가능하다.
따라서 코로나19 완치자의 혈액에서 항체를 지속적으로 채취할 필요 없이 유전자 재조합된 세포를 이용해 중화항체를 대량 생산할 수 있다.
경증부터 중등증까지의 코로나19 환자 대상 임상 2상 완료
기존에 치료제로 허가된 베클루리주(렘데시비르)는 세포 내 감염된 코로나19 바이러스의 복제를 억제하는 반면, 렉키로나주(레그단비맙)는 코로나19 바이러스의 표면에 있는 인체 세포 결합 부위(Receptor Binding Domain)에 항체치료제가 대신 결합해 바이러스가 세포 내로 침투되는 것을 막게 된다.
식약처는 "렉키로나주의 예상 대상환자는 경증부터 중등증까지의 코로나19 환자다. 예상 용법과 제형은 90분간 정맥투여하는 주사제로, 예상 효능‧효과는 경증~중등증 코로나19 환자의 치료"라고 설명했다.
이어 "임상 2상이 10개월로 대폭 단축된 것은 식약처가 2월 개발 초기부터 허가신청까지 제조사와 밀접한 상담을 했기 때문"이라며 "탐색적 의미와 치료적 효과를 함께 확인할 수 있는 2상 임상시험이 설계될 수 있도록 대상 환자 확대 권고, 전문가 자문 등도 지원했다"고 밝혔다.
셀트리온은 식약처로부터 2상과 3상을 동시에 승인받은 다국가 임상시험 중 2상을 완료하고 허가를 신청하는 것으로, 3상은 이번 허가신청과는 관계없이 계획대로 진행될 예정이다.
2상은 경증~중등증의 코로나19 환자 327명을 대상으로 발열 등 7가지 코로나19 증상에 대한 회복 기간 단축과 바이러스 검사 시 양성에서 음성으로 전환하는 데 걸리는 기간 단축을 확인하는 것을 목표로 했다. 3상은 경증~중등증의 코로나19 환자 720명을 대상으로 산소 치료가 필요하거나 입원하는 등 증상이 악화되는 비율이 감소하는지 확인하는 것을 계획하고 있다.
식약처는 "앞으로 제출된 자료에 대해 첨단제품허가담당관이 예비심사한 후, 미리 구성된 코로나19 백신·치료제 허가전담심사팀의 분야별 전문가가 비임상, 임상, 품질 등 허가에 필요한 자료에 대해 심사하게 된다"면서 "이후 심사의견을 종합해 허가 타당성을 판단하고, 외부 전문가로 구성된 중앙약사심의위원회 자문 등을 거쳐 최종 허가할 예정"이라고 했다.
이어 "안전하고 효과 있는 코로나19 치료제가 국민에게 사용될 수 있도록 코로나19 백신·치료제 허가전담심사팀의 분야별 전문가와 외부 전문가 등을 활용해 안전성‧효과성을 철저히 검증하겠다"고 부연했다.
허가·심사 과정은? 비임상부터 제조, 위해성관리 등 전반 검토 시행
허가·심사 자료는 비임상시험, 임상시험, 품질, 위해성관리계획, 제조·품질관리 자료 등이다. 비임상시험 자료는 의약품을 사람에 투여하기 전에 동물실험을 통해 독성 및 효과를 검증한 자료이며, 임상시험 자료는 사람에게 투여했을 때 안전성과 효과성을 확인한 자료다.
품질자료는 해당 의약품의 제조공정관리, 품질관리를 위한 기준 및 시험방법 등에 관한 자료며, 위해성관리계획(RMP)은 환자용 사용설명서, 안전사용 보장조치 등 위해성 완화 조치방법을 포함하는 종합적인 안전관리 계획에 관한 자료다.
제조‧품질관리 기준(GMP) 실시상황평가 자료는 허가신청 품목과 관련된 시설·환경관리, 품질보증체계 등 10여종 자료다.
식약처는 "발열, 기침 등 환자의 증상 개선, 바이러스가 양성에서 음성으로 전환되는 기간 감소 등 치료효과를 확인하고, 안전성과 품질 확보 측면을 중점적으로 심사할 계획"이라며 "임상시험 대상자 안전과 시험결과의 신뢰성 등 임상시험 전반에 대한 규정 준수를 확인하고, 사전검토 결과를 포함해 제조소 실태조사를 실시할 계획"이라고 밝혔다.
이외에도 제출자료의 타당성과 임상현장에서의 수용성 등에 대해 독성전문가, 감염내과 등 전문의 등으로 구성된 코로나19 치료제 전문가협의체에 외부 자문 등을 의뢰하고, 최종적으로 중앙약사심의위원회의 자문을 받을 계획이다.
식약처는 신청 제품에 대한 허가심사 및 전문가 자문 결과 안전성‧효과성이 충분히 확인되는 경우, 현재 진행 중인 3상 임상시험 결과를 허가 후에 제출하는 것을 조건으로 허가한다는 방침이다. 특히 기존 처리 기간이 180일 이상인 것과 달리, 코로나19 백신·치료제인만큼 신속한 허가·심사를 위해 40일 이내에 처리할 예정이다.
한편 국내에서는 렉키로나주를 비롯해 코로나19 치료제로 개발 중인 항체치료제 등 총 15개 제품(13개 성분)에 대한 임상시험이 진행 중이다. 렉키로나주는 우리나라 외에도 미국, 유럽 등으로부터 임상 2/3상을 승인받아 진행 중이며, 내년부터 긴급사용승인(미국), 조건부 허가(유럽) 가능 여부 상담 등을 통해 해외 진출을 계획하고 있다.
국외의 경우 릴리社와 리제네론社의 항체치료제가 3상 임상시험을 진행하고 있으며, 미국에서 긴급사용승인을 받았다.
저작권자© 메디게이트뉴스, 무단 전재 및 재배포 금지
서민지 기자 (mjseo@medigatenews.com)
전체 뉴스 순위
칼럼/MG툰
English News
- LOTTE BIOLOGICS Hosts Technology Development Forum to Foster Future Innovation
- Hanmi Highlights Next-Generation Obesity Pipelines at ObesityWeek 2025
- SK bioscience Earns 'A' Rating in KCGS ESG Assessment for Fourth Consecutive Year
- Huons N to Acquire Health Functional Food Manufacturer 'Biorosette'
- European Commission Grants Approval of Remsima IV Liquid Formulation, World's First Liquid Formulation of IV Infliximab
유튜브
사람들